2020中国医药产业前瞻来源:赛柏蓝——张自然网址:http://news.PharmNet.com.cn
1月6日讯 2020,带量采购全国执行; 2020,重点药品监控机制全面建立; 2020,DRG在30个试点城市模拟运行; 2020,2019版《医保目录》实施,省级医保目录缩编三年过渡期开始; 在以带量购为突破口的新医改形势下,中国医药产业的增长模式将由公关、销售驱动型变为成本、技术驱动型,并形成以大型骨干企业为主体、中小型企业为补充的药品生产、流通格局。 一、颠覆 1、4+7 2019年11月29日,国务院深化医改领导小组印发的《关于以药品集中采购和使用为突破口进一步深化医药卫生体制改革若干政策措施的通知》要求,以药品集采为突破口,促进三医联动。 2019年12月29日,国家集采联采办发布的《全国药品集中采购文件(GY-YD2019-2)》,标志着国家带量采购的4+7试点经验正式向全国推广。 先期试行的4+7和4+7扩围分别将药价平均降低了52%和25%,最小规格的最低价也由以“角”为单位下降到以”分“为单位,由4+7时的0.149元(京新的苯磺酸氨氯地平片5mg)、下降到4+7扩围的0.049元(齐鲁的利培酮片1mg)、再降到河北集采通过一致性评价的0.022元(石药集团卡托普利片25mg)和尚未通过一致性评价的0.012元(山东鲁西药业硝苯地平片10mg),第二批国家带量采购还没开始,仅其规定的最高有效报价的最低价就已低至0.1元(对乙酰氨基酚0.5g和甲硝唑0.2g)。 2019年11月20日,国务院常务会议提出“以带量采购促进药价实质性降低”,可见,降价已成这轮改革的主旋律,但即使愿意承受降价,也必将有相当一部分过评企业肯定无缘中选,因尽管第二批带量采购已放宽到最多可6家同时中标,但如阿莫西林等的过评企业数已远超6家。 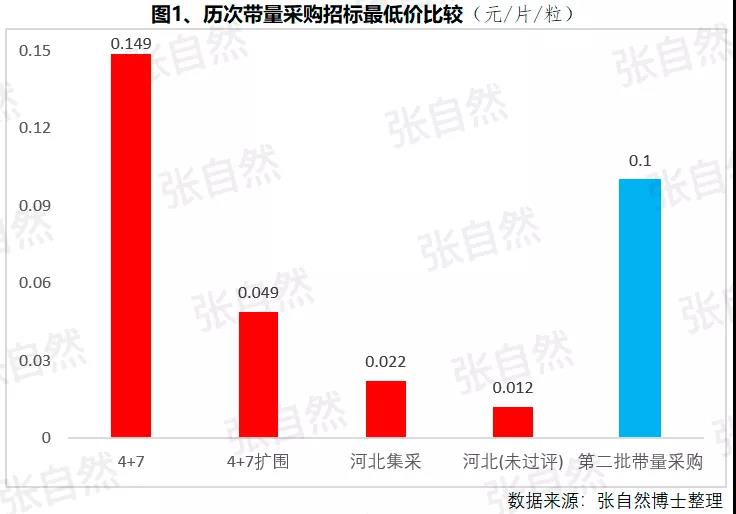 此外,作为参与带量采购的前提,必须先做一致性评价,而做一致性评价要付出巨额费用。 据医药魔方统计,自2018年1月2号至2019年10月23日,共披露了65个品种(不含视同通过)一致性评价的费用支出情况,最低的仅154万元、最高的达2011.09万元,其中,154~500万元的有18家占28%、超过1500万元的有2家占3%,而500万元以下的多是中外共线生产的国际化企业回归后申报而享有绿色通道过评的,如华海就有7个产品的费用在159~302万元之间,所以,此非一般企业可以享有,更多的将要付出至少中位数678万元。 我国有76%的制药企业的年营收还不足2000万元(中国医药工业信息中心,中国健康产业蓝皮书2018),尽管很多地方也出台了补助政策《数百亿原研药,或被一致性评价药品挤掉》,但也多是锦上添花而已,所以至少这76%的企业凭自身是没有能力负担一致性评价费用的。 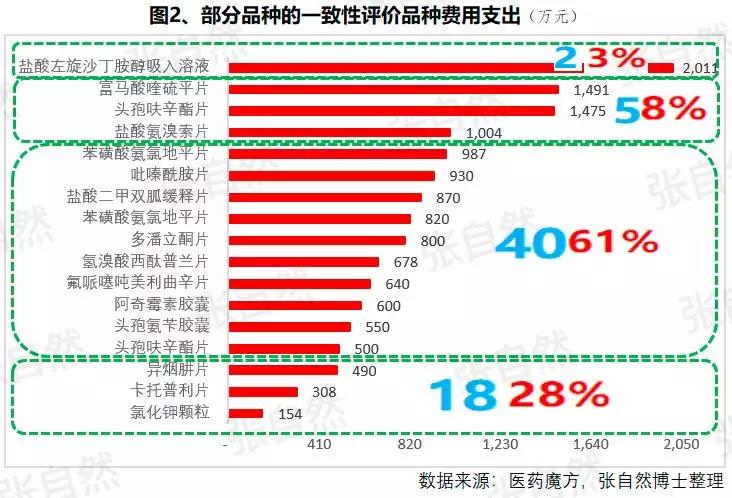 鉴于做一致性评价要付出巨额费用,过评后还要再经4+7杀价,且还不能确保中选,所以,一致性评价申请数量由4+7开标之前的2019年1月达到高峰时的207个,骤降到2月份的73个,而现在已由为获利转为兼顾获利和生存的双重考量,去年12月份申报数为110个。 2、重点监控 2019年11月15日《国务院深化医药卫生体制改革领导小组关于进一步推广福建省和三明市深化医药卫生体制改革经验的通知》(二、9条)指出“2019年12月底前,各省份要制定出台省级重点监控合理用药药品目录(化药及生物制品)并公布,2020年12月底前全面建立重点药品监控机制。” 据医药云端工作室统计,截止2019年12月29日,已有22省、16市、11家医院公开了重点监控药品目录,涉及203个品种,其中,内蒙等14省/直辖市与国家版一致,江西等9省在国家版基础上都做了数量上的增加,有些地方版增加数量较多、并多有中药/且大部分是中药注射剂,如山东威海增加了98种,其中有44个中药,且绝大部分是中药注射剂。 4+7影响的是化药制剂,重点监控冲击的多是不做一致性评价也不参与4+7的中药和生化药,对本土药企将是双重打击,因外企没有中药和生化神药。在国家重点监控目录出台之前,这20个重点监控品种的销量已大幅下降了,重点监控目录出台后降幅还将加大。《8张图表:系统剖析医改最新进展》 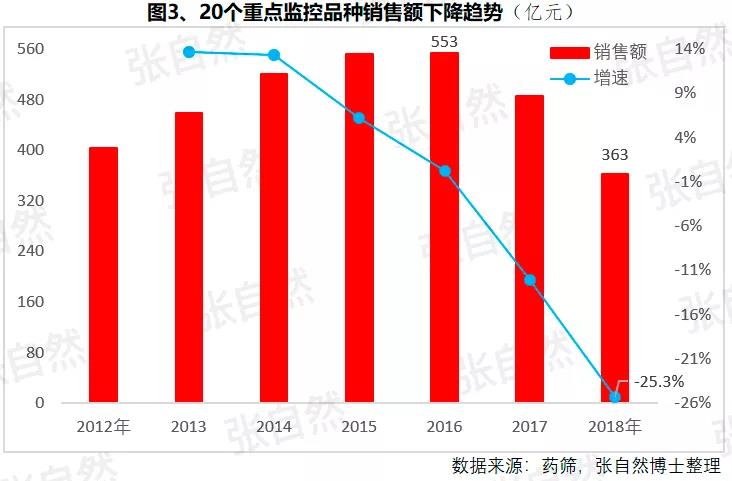 3、DRG 2019年10月16日,国家医疗保障局发布的《关于印发疾病诊断相关分组(DRG)付费国家试点技术规范和分组方案的通知》为我国DRG行业发展扫清了障碍。 尽管DRG不是专门针对药品的,但在“全面取消以药养医”(十九大报告)和以降药价为突破口的新医改背景下,作为占用医保资金较大份额的药品销售将难以规避,在DRG预付费的前提下,医院和医生出于不要透支的底限,大处方、不必要的检查和性价比不高的药品将被限制,合理用药水平将大幅提升,DRG可谓扩展版的重点监控。 据IQVIA统计(≥100张病床的医院),在能口服就不注射、地方版辅助用药目录和限抗的大背景下,自2015年至2019年连续5年的第二季度比较,中药(主要是中药注射剂)、大输液、辅助用药和抗生素分别下降了3.9%、1.3%、4.9%、1.1%,而治疗性用药却上升了11.1%,腾笼换鸟效果明显。 而就上述非治疗性用药(暂以此代称)而言,本土药企分别占了(2017年)99.7%、85.4%、88%和77.6%,实施DRG后,上述变化将更加放大,可见,DRG对药品销售还将是有较大影响的,对本土药企影响尤甚。《收藏 ︳DRG下,药企3大对策》  在4+7、重点监控和DRG等政策的叠加影响以及印度药企的虎视眈眈下《印度仿制药真相》,中国医药产业以公关、销售为主的盈利模式将渐被终结,仿制药企业的高利润率时代也将成为历史,而是与国际接轨,进入靠规模、成本制胜的低利润率时代。 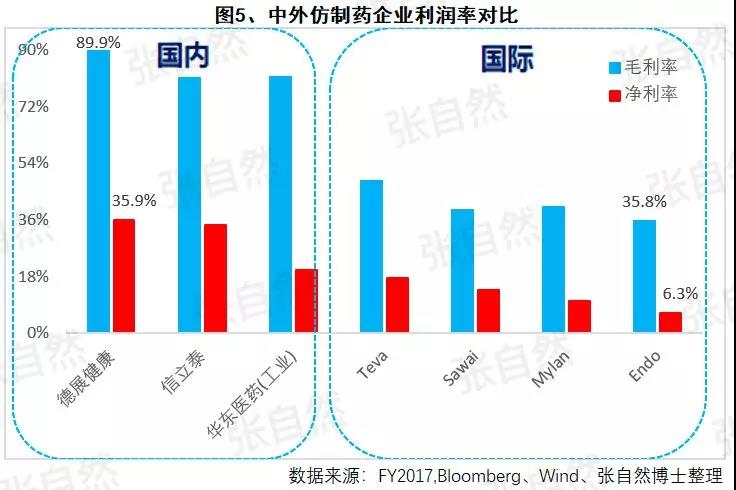 二、重构 1、以大型企业为主体 2019年11月6日,国家发改委发布的《中华人民共和国国家发展和改革委员会令》(第92号),《产业结构调整指导目录(2019年本)》明确限制6项、淘汰13项医药类项目。 2019年11月29日,国务院深化医改领导小组发布的《关于以药品集中采购和使用为突破口进一步深化医药卫生体制改革的若干政策措施》要求,推动药品生产与流通企业跨地区、跨所有制兼并重组,培育一批具有国际竞争力的大型企业集团,加快形成以大型骨干企业为主体、中小型企业为补充的药品生产、流通格局。 日本的药品批文和制药企业数量分别由一致性评价之前的10万个、1359家下降到一致性评价之后的1.9万个和300家,而这300家中生产仿制药的仅20家。 美国医药市场规模约是我国的4倍,但其实际有产品销售的药厂也就800多家,而我国现有制剂药厂3262家(中国医药企业管理协会),百强占比也仅47.8%(2017年)。此前,试图以GMP等多项政策治理小散乱,但收效并不显著。 本次不是针对GMP证书而是釜底抽薪,针对批文下手,没有通过一致性评价的企业自然也就不能算是药厂了,而面对一致性评价的巨额支出、4+7降价环境,相对于10多万个化药批文而言,能过评的将是少数。 所以这次小散乱将得以治理,相应的集中度也将大幅提高,从而实现官方“加快形成以大型骨干企业为主体、中小型企业为补充的药品生产、流通格局”的目标。 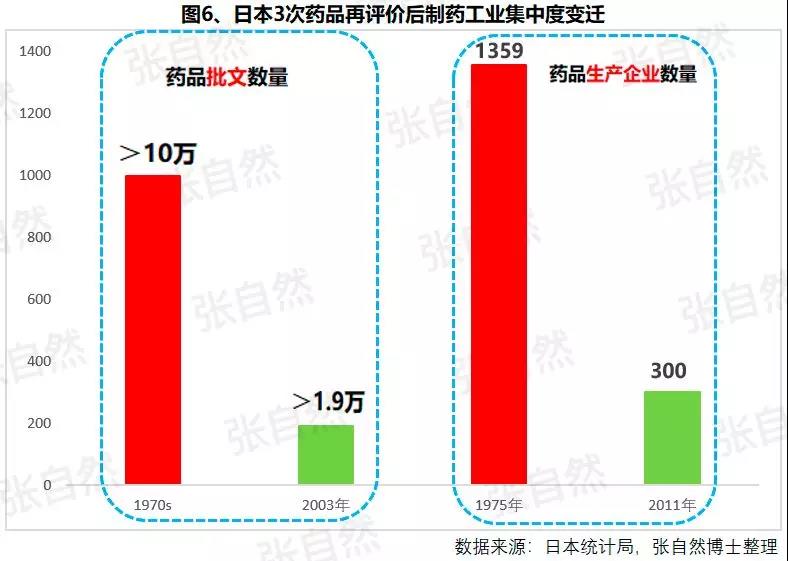 2、专业分工(MAH) 拥有研、产、销全部功能的全能药厂只能是少数大型企业集团,而中小企业只有聚焦细分领域做精做强才有出路,药品研发、生产、营销各环节也将分别以CRO、C(D)MO、CSO的专业分工形式出现。 由于成本较低、高校生源丰富、资本市场日臻完善,尤其近几年药品审评审批制度改革和大量海归科学家的加入,我国的CRO和C(D)MO始终以20%左右的速度增长,CRO和C(D)MO在全球的占比将由2013年的11.6%、6.9%上升到2021年的26.8%和10%。 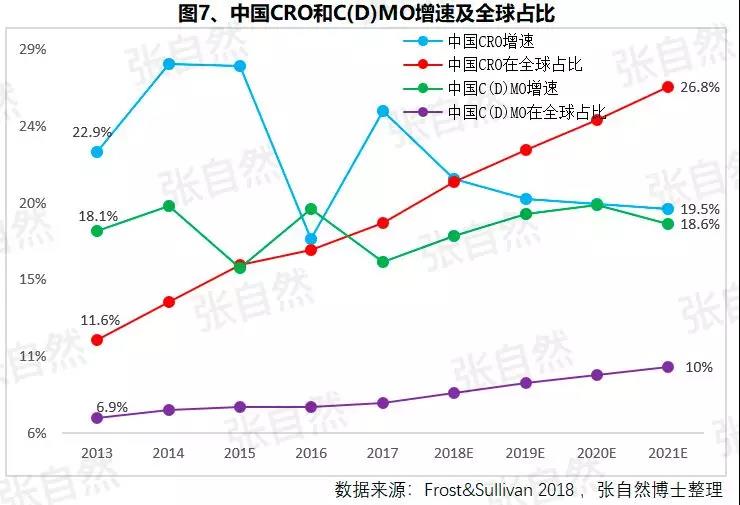 3、优化产品结构 (1)创新 自从2015年国务院发布44号文以来,我国开启了医药创新向世界接轨的大幕,尤其加入ICH、新的《药品管理法》颁布、2019版医保目录的调整和科创板的设立,都为我国的医药创新创造了前所未有的大好环境。 同时,中国的医药创新也确实取得了可喜的成果,据权威的GEN网站统计,以今年10月30日收市市值计,全球生物技术市值TOP25企业中国就占了5席,以研发见长的恒瑞、药明康德和翰森分别名列第7(3988亿元)、14(1355亿元)和第16位(1395亿港元)。 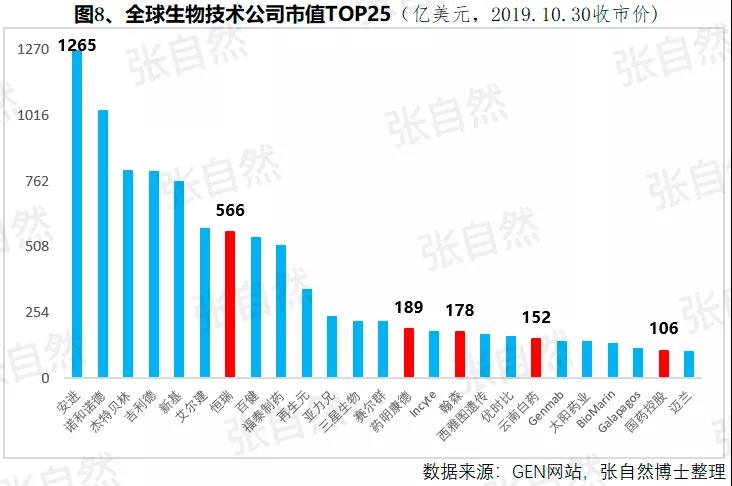 (2)仿制 以4+7为试点的国家带量采购旨在加速仿制药替代,大幅降低患者负担,2018年12月29日,国家卫建委等十二部委局院联合发布的《关于印发加快落实仿制药供应保障及使用政策工作方案的通知》要求,2020年起,每年年底前发布鼓励仿制的药品目录,《第一批鼓励仿制药品目录》33种已由国家卫健委于2019年10月9日发布。 作为仿制药大国,我国的仿制药一直未能行使替代原研药的天职,4+7宣告了这一历史的结束。 随着创新环境的不断完善和带量采购的全面推广,创新药和仿制药的占比将分别由2010年的5%、0%上升到2030年的45%和25%,而其他非治疗性药品的占比将大幅下降,我国的用药结构将大幅优化。 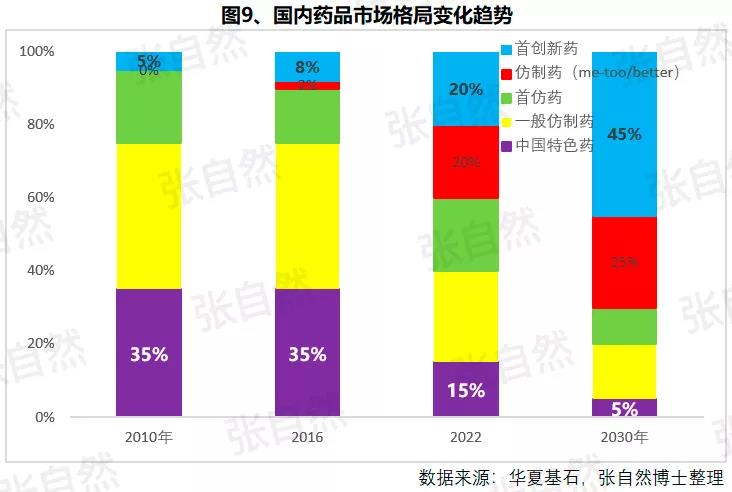 而原料制剂一体化的企业更具竞争优势,如以原料国际化为代表的浙江华海药业,在4+7和4+7扩围时分别以6个和7个中选而连续第一,且在4+7时小于1元的12个最低价中占有3个。 三、展望 4+7涉及的品种数量还不多、一致性评价还有个过程(美日都经历了20多年),DRG尚在试点,要全国推广还是几年之后的事,所以,目前的不利影响心理大于实际,但产品立项选择、企业战略调整等重构也需相应资源配置和一定的时间,因此,企业应未雨绸缪,尽早付诸行动。 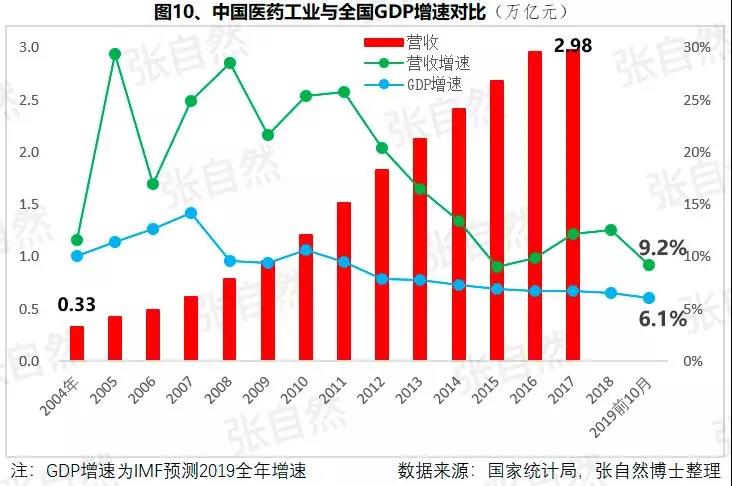 自2013年开始,中国医药市场规模已连续6年跻身全球第二,已由2004年的3300亿元猛增到2017年的29826亿元(因2018年之后改变了统计口径,故图10未标注营收值,但增速仍具可比性),且随着老龄化的加剧和人民健康意识的提高,规模还在继续扩大。 尽管近10年来,也进入了低速增长的新常态,但增速仍远高于GDP增速,2019年1-10月,中国医药工业营收增速达9.2%,仍比全国GDP增速6.1%高出50%还多,中国的医药市场规模已令众多跨国药企垂涎并战略加持了对中国的重视,作为近水楼台的中国本土药企,经过结构优化、转型升级之后将赢得更多发展先机。 以全球新的创新药和能替代原研的仿制药的用药结构、以大型骨干企业为主体的中国药品生产、流通格局将被重构。大幅提高药物可及性,为决胜全面建成小康社会做出特殊贡献。
|




