3000亿创新药市场大爆发!5个独家国产药卖得最火 44个新药在审来源:米内网网址:http://news.PharmNet.com.cn
11月26日讯 米内网数据显示,2018年中国公立医疗机构终端化学药销售规模10325亿元,其中仿制药销售额7226亿元,原研及国产创新药销售额3099亿元。近年来,优先审评审批、医保谈判等政策为创新药发展“亮绿灯”,而受一致性评价、全国集采等政策影响,仿制药占化药比重逐年降低,增速大幅放缓,创新药将成为医药行业发展新引擎。 2018年中国公立医疗机构终端原研药TOP10品牌合计销售额约500亿元,多个已过专利期原研药将逐渐退出药品畅销榜;独家国产新药TOP5品牌合计销售额约105亿元,阿帕替尼增长迅猛。2016年3月至今,CDE承办受理的申报上市的1类新药共计36个,其中10个品种已获批上市,26个品种在审;2类改良型新药有22个,其中3个品种已获批上市,1个品种不批准,18个品种在审。 超7000亿市场萎缩,创新药成医药行业发展新引擎 米内网数据显示,2018年中国公立医疗机构终端化学药销售额为10325亿元,同比去年增长7.36%。其中仿制药是“主力军”,销售额达7226亿元,占整个化药市场70%的比例,由4593个品种构成,涉及2694个厂家;原研药及国产创新药销售额达3099亿元,占整个化药市场30%的比例,由1073个品种构成,涉及235个厂家。 从药物治疗类别看,原研药及国产创新药专注于抗肿瘤和免疫调节剂、呼吸系统用药、感觉系统用药、心血管系统用药、消化系统及代谢药、生殖泌尿系统和性激素类药物等领域,而仿制药则专注于全身用抗感染药物、皮肤病用药、神经系统用药等。 图1:2015-2018年中国公立医疗机构终端原研药与仿制药增速情况 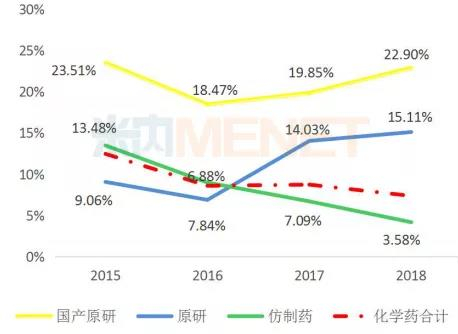 近几年来,国产创新药、原研药、仿制药在中国公立医疗机构终端的增速均出现不同程度波动,而最大转折点出现在2016年。2016年国家出台了新药优先审评审批、首批国家医保谈判等政策,鼓励创新药研发,提高了新药用药可及性,因此国产创新药及原研药得以快速发展。 米内网医院中心总监周春宣在近日召开的2019年全国医药经济信息发布会上表示,2018年中国公立医疗机构终端仿制药的增速仅3.58%,低于化学药整体增速,仿制药占化药市场比重逐年降低。 随着仿制药一致性评价持续推进,越来越多的省市暂停采购未过评药品;首批4+7集采及联盟集采开展,25个品种大幅降价,近日国务院发文要求2020年启动扩品种集采;20个国家重点监控药品公布后,各省市也陆续发布目录并执行......受重点监控、合理用药、带量采购等政策影响,仿制药的增速将持续放缓,超7000亿市场进一步萎缩。 2018年国务院机构改革方案公布后,一个又一个鼓励创新的政策下发,如简化境外已上市药品进口审批、进口抗癌药零关税等政策加速进口原研药进入国内市场,仿制药一致性评价、国家带量采购等政策倒逼国内药企向新药研发转型......在诸多政策加持下,2019年国产创新药及原研药的增速将进一步提升,成为医药行业发展的“新引擎”。 5个独家国产新药卖得最火,已过专利期原研药受挫 表1:2018年中国公立医疗机构终端原研药TOP10品牌(单位:亿元) 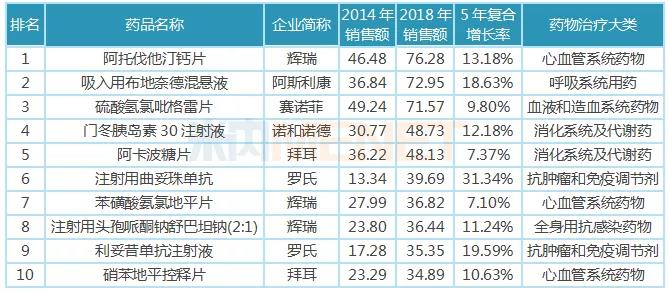 米内网数据显示,2018年中国公立医疗机构终端原研药TOP10品牌合计销售额500.84亿元,10个药品集中在降血脂、降血糖、降血压等慢病用药及抗肿瘤用药领域。7个品牌5年复合增长率达到两位数,罗氏的注射用曲妥珠单抗及利妥昔单抗注射液、阿斯利康的吸入用布地奈德混悬液增速较快。 辉瑞的阿托伐他汀钙片及苯磺酸氨氯地平片、赛诺菲的硫酸氢氯吡格雷片已被纳入首批4+7集采及联盟集采,拜耳的阿卡波糖片大概率入选扩品种集采。这些已过专利期的药品在全国大幅度降价,不久之后将陆续退出TOP10排名;罗氏的注射用曲妥珠单抗、利妥昔单抗注射液保持快速增长,但复宏汉霖的利妥昔单抗生物类似药已获批上市,三生国健、复宏汉霖已提交曲妥珠单抗生物类似药的上市申请,罗氏在国内将面临这些生物类似药的挑战。 图2:2016-2019年CDE受理的 5.1 类进口注册受理号 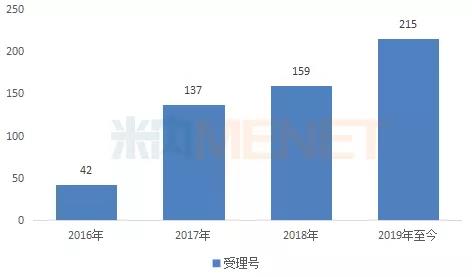 虽然已过专利期原研药会被优质仿制药逐步代替,但专利原研药迎利好。鼓励创新的政策于2016年开始陆续发布,申请进口的原研药也随着增加,米内网数据显示,2019年至今,CDE承办受理的 5.1 类进口注册受理号(含补充申请)已达215个。 表2:2018年中国公立医疗机构终端独家国产新药TOP5品牌(单位:亿元) 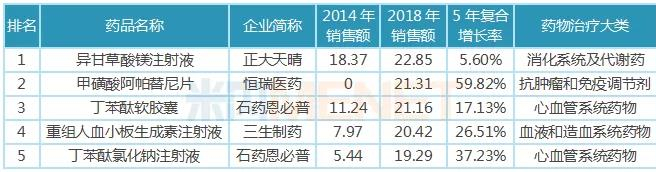 5个独家国产新药在2018年中国公立医疗机构终端合计销售额105.03亿元,石药恩必普药业有2个品种上榜,丁苯酞软胶囊是国内第3个自主研发的国家1类新药,也是国际上首个用于急性缺血性脑卒中多个病理环节的创新药物,丁苯酞氯化钠注射液相对于软胶囊从剂型上更适合于急性缺血性脑卒中患者早期使用;恒瑞的甲磺酸阿帕替尼片于2014年10月获批上市,2015年在中国公立医疗机构终端的销售额即突破5亿元,增速迅猛。 44个新药在审,恒瑞、人福猛攻抗肿瘤药、麻醉剂 我国对新药的定义经历了多次变更,从1985年“我国未生产过的药品”,到2002年更改为“未曾在中国境内上市销售的药品”,直到2015年才确定为“未在中国境内外上市销售的药品”,新药从“中国新”到“全球新”的转变,整整摸索了30年。2016年3月4日,《化学药品注册分类工作改革方案》正式出台,明确定义了创新药、改良型新药以及仿制药。 根据新化学药品注册分类方案,新药包括境内外均未上市的1类创新药以及境内外均未上市的2类改良型新药。据米内网统计,2016年3月至今,CDE承办受理的申报上市的1类新药共计36个(以药品名+企业计,下同),其中10个品种已获批上市,26个品种在审;2类改良型新药有22个,其中3个品种已获批上市,1个品种不批准,18个品种在审。 表3:2016年3月至今申报上市的国产新药(不含生物药) 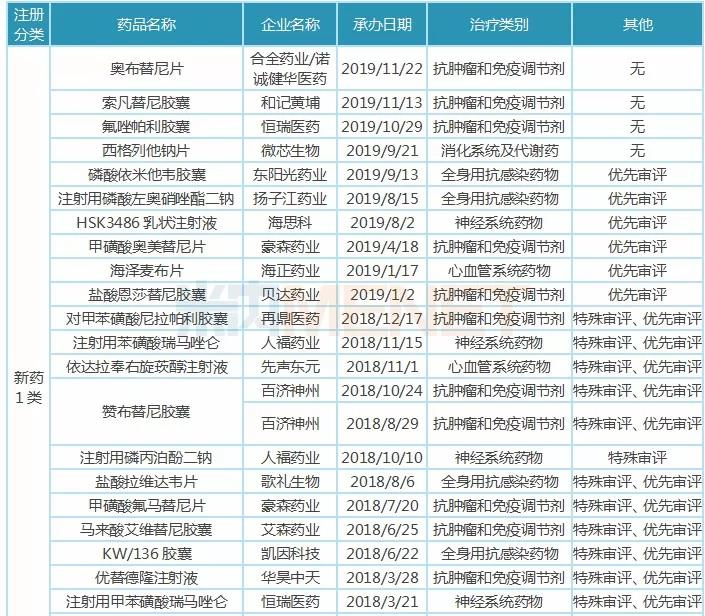 自2016年实施新药优先审评审批后,特殊审评审批、原辅包关联审评审批等政策陆续出台,大大提高了新药审评审批速度,新药上市速度得以提升。44个在审新药有26个属于1类创新药,其中有6个品种被纳入优先审评,有1个品种被纳入特殊审评,有14个品种既被纳入优先审评,也被纳入特殊审评。 44个在审新药涵盖10个药物治疗大类,其中有15个品种属于抗肿瘤和免疫调节剂,有11个品种属于全身用抗感染药物,有8个品种属于神经系统药物;从申请企业看,恒瑞医药、豪森药业均以2个1类新药、1个2类新药并列首位,人福有2个1类新药申报上市,均为麻醉镇痛药。 来源:米内网数据库
|




